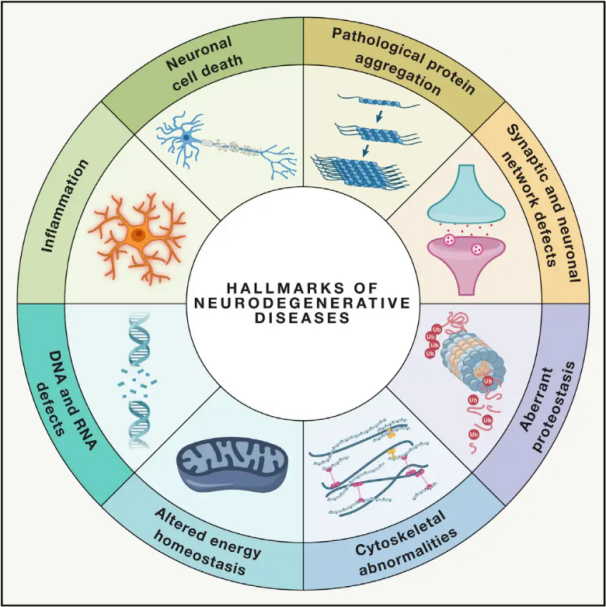
Неуродегенеративне болести(НДД) карактерише прогресивни или перзистентни губитак специфичних осетљивих неуронских популација у мозгу или кичменој мождини. Класификација НДД може се заснивати на различитим критеријумима, укључујући анатомску дистрибуцију неуродегенерације (као што су екстрапирамидални поремећаји, фронтотемпорална дегенерација или спиноцеребеларне атаксије), примарне молекуларне абнормалности (као што су амилоид-β, приони, тау или α-синуклеин) или главне клиничке карактеристике (као што су Паркинсонова болест, амиотрофична латерална склероза и деменција). Упркос овим разликама у класификацији и презентацији симптома, поремећаји попут Паркинсонове болести (ПБ), амиотрофичне латералне склерозе (АЛС) и Алцхајмерове болести (АБ) деле заједничке основне процесе који доводе до неуронске дисфункције и коначне ћелијске смрти.
Са милионима људи широм света погођених неуродегенеративним поремећајима (НДД), Светска здравствена организација процењује да ће до 2040. године ове болести постати други водећи узрок смрти у развијеним земљама. Иако постоје различити третмани доступни за ублажавање и управљање симптомима повезаним са одређеним болестима, ефикасне методе за успоравање или лечење прогресије ових стања остају недостижне. Недавне студије указују на промену парадигми лечења од пуког симптоматског лечења до коришћења механизама заштите ћелија како би се спречило даље погоршање. Обимни докази указују на то да оксидативни стрес и упала играју кључну улогу у неуродегенерацији, позиционирајући ове механизме као критичне мете за ћелијску заштиту. Последњих година, фундаментална и клиничка истраживања открила су потенцијал хипербаричне кисеонске терапије (ХБОТ) у лечењу неуродегенеративних болести.
Разумевање хипербаричне оксигенотерапије (ХБОТ)
ХБОТ обично подразумева повећање притиска изнад 1 апсолутне атмосфере (АТА) — притиска на нивоу мора — у трајању од 90-120 минута, што често захтева више сеанси у зависности од специфичног стања које се лечи. Повећани ваздушни притисак побољшава испоруку кисеоника ћелијама, што заузврат стимулише пролиферацију матичних ћелија и побољшава процесе зарастања посредоване одређеним факторима раста.
Првобитно, примена ХБОТ-а је заснована на Бојл-Мариотовом закону, који постулира смањење мехурића гаса зависно од притиска, уз предности високог нивоа кисеоника у ткивима. Постоји низ патологија за које се зна да имају користи од хипероксичног стања изазваног ХБОТ-ом, укључујући некротична ткива, повреде од зрачења, трауме, опекотине, синдром компартмента и гасну гангрену, између осталих које је навело Подморско и хипербарично медицинско друштво. Приметно је да је ХБОТ такође показао ефикасност као додатни третман код различитих модела инфламаторних или инфективних болести, као што су колитис и сепса. С обзиром на своје антиинфламаторне и оксидативне механизме, ХБОТ нуди значајан потенцијал као терапијски пут за неуродегенеративне болести.
Преклиничке студије хипербаричне оксигенотерапије код неуродегенеративних болести: Увиди из 3×Tg модела миша
Једна од значајних студијафокусирало се на 3×Tg мишји модел Алцхајмерове болести (АБ), који је показао терапеутски потенцијал ХБОТ-а у ублажавању когнитивних дефицита. Истраживање је обухватило 17-месечне мужјаке 3×Tg мишева у поређењу са 14-месечним мужјацима C57BL/6 мишева који су служили као контрола. Студија је показала да ХБОТ не само да побољшава когнитивну функцију већ и значајно смањује упалу, оптерећење плаком и фосфорилацију тау протеина – критични процес повезан са патологијом АБ.
Заштитни ефекти ХБОТ-а приписани су смањењу неуроинфламације. То је доказано смањењем микроглијалне пролиферације, астроглиозе и лучења проинфламаторних цитокина. Ови налази наглашавају двоструку улогу ХБОТ-а у побољшању когнитивних перформанси, а истовремено ублажавању неуроинфламаторних процеса повезаних са Алцхајмеровом болешћу.
Још један преклинички модел користио је мишеве са 1-метил-4-фенил-1,2,3,6-тетрахидропиридином (МПТП) за процену заштитних механизама ХБОТ-а на неуронску функцију и моторичке способности. Резултати су показали да ХБОТ доприноси побољшаној моторичкој активности и снази хвата код ових мишева, што је у корелацији са повећањем сигнализације митохондријалне биогенезе, посебно кроз активацију SIRT-1, PGC-1α и TFAM. Ово истиче значајну улогу митохондријалне функције у неуропротективним ефектима ХБОТ-а.
Механизми ХБОТ-а код неуродегенеративних болести
Основни принцип коришћења ХБОТ-а за неуродегенеративне болести лежи у вези између смањеног снабдевања кисеоником и подложности неуродегенеративним променама. Хипоксијом индуцибилни фактор-1 (HIF-1) игра централну улогу као транскрипциони фактор који омогућава ћелијску адаптацију на низак притисак кисеоника и повезан је са различитим неуродегенеративним болестима, укључујући Алцхајмерову болест, Паркинсонову болест, Хантингтонову болест и АЛС, што га означава као кључну мету лекова.
С обзиром на то да је старост значајан фактор ризика за вишеструке неуродегенеративне поремећаје, истраживање утицаја ХБОТ-а на неуробиологију старења је од виталног значаја. Студије су показале да ХБОТ може побољшати когнитивне дефиците повезане са старењем код здравих старијих особа.Поред тога, старији пацијенти са значајним оштећењима памћења показали су когнитивна побољшања и повећан церебрални проток крви након излагања ХБОТ-у.
1. Утицај ХБОТ-а на упалу и оксидативни стрес
ХБОТ је показао способност ублажавања неуроинфламације код пацијената са тешком дисфункцијом мозга. Поседује способност да смањи проинфламаторне цитокине (као што су IL-1β, IL-12, TNFα и IFNγ), док истовремено повећава антиинфламаторне цитокине (као што је IL-10). Неки истраживачи претпостављају да реактивне врсте кисеоника (ROS) које генерише ХБОТ посредују у неколико корисних ефеката терапије. Сходно томе, поред његовог дејства смањења мехурића зависног од притиска и постизања високе засићености ткива кисеоником, позитивни исходи повезани са ХБОТ делимично зависе од физиолошких улога произведених ROS.
2. Ефекти ХБОТ-а на апоптозу и неуропротекцију
Истраживања су показала да ХБОТ може смањити фосфорилацију митоген-активиране протеин киназе (МАПК) п38 у хипокампусу, што последично побољшава когницију и смањује оштећење хипокампуса. Утврђено је да и самостална ХБОТ и у комбинацији са екстрактом гинка билобе смањују експресију Bax-а и активност каспазе-9/3, што резултира смањењем стопе апоптозе код глодарских модела индуковане помоћу aβ25-35. Штавише, друга студија је показала да прекондиционирање ХБОТ-а индукује толеранцију на церебралну исхемију, са механизмима који укључују повећану експресију SIRT1, уз повећане нивое Б-ћелијског лимфома 2 (Bcl-2) и смањену активну каспазу-3, што истиче неуропротективна и антиапоптотичка својства ХБОТ-а.
3. Утицај ХБОТ-а на циркулацију иНеурогенеза
Излагање испитаника ХБОТ-у повезано је са вишеструким ефектима на кранијални васкуларни систем, укључујући повећање пропустљивости крвно-мождане баријере, подстицање ангиогенезе и смањење едема. Поред обезбеђивања повећаног снабдевања ткива кисеоником, ХБОТподстиче формирање васкуларних крвних судоваактивирањем транскрипционих фактора попут васкуларног ендотелног фактора раста и стимулисањем пролиферације неуралних матичних ћелија.
4. Епигенетски ефекти ХБОТ-а
Студије су откриле да излагање људских микроваскуларних ендотелних ћелија (HMEC-1) хипербаричном кисеонику значајно регулише 8.101 гена, укључујући и појачане и смањене експресије, што истиче повећање експресије гена повезано са путевима антиоксидативног одговора.
Закључак
Употреба ХБОТ-а је временом направила значајан напредак, доказујући њену доступност, поузданост и безбедност у клиничкој пракси. Иако је ХБОТ испитиван као ванрегистровани третман за неуралгијске поремећаје дејства (НДД) и спроведена су нека истраживања, и даље постоји хитна потреба за ригорозним студијама како би се стандардизовале праксе ХБОТ-а у лечењу ових стања. Даља истраживања су неопходна како би се одредила оптимална учесталост лечења и проценио обим корисних ефеката за пацијенте.
Укратко, пресек хипербаричног кисеоника и неуродегенеративних болести показује обећавајућу границу у терапијским могућностима, што захтева континуирано истраживање и валидацију у клиничким условима.
Време објаве: 16. мај 2025.

