У области модерне медицине, антибиотици су се показали као један од најзначајнијих напредака, драматично смањујући стопу инциденце и морталитета повезаних са микробним инфекцијама. Њихова способност да промене клиничке исходе бактеријских инфекција продужила је животни век безброј пацијената. Антибиотици су кључни у сложеним медицинским процедурама, укључујући операције, постављање имплантата, трансплантације и хемотерапију. Међутим, појава патогена отпорних на антибиотике представља све већу забринутост, смањујући ефикасност ових лекова током времена. Случајеви резистенције на антибиотике документовани су у свим категоријама антибиотика како се јављају микробне мутације. Селекциони притисак који врше антимикробни лекови допринео је порасту резистентних сојева, што представља значајан изазов за глобално здравље.
Да би се суочио са хитним проблемом антимикробне резистенције, неопходно је спровести ефикасне политике контроле инфекција које ограничавају ширење резистентних патогена, уз смањење употребе антибиотика. Штавише, постоји хитна потреба за алтернативним методама лечења. Хипербарична оксигенација (ХБОТ) се појавила као обећавајућа метода у овом контексту, која укључује удисање 100% кисеоника под одређеним нивоима притиска током одређеног временског периода. Позиционирана као примарни или комплементарни третман за инфекције, ХБОТ може понудити нову наду у лечењу акутних инфекција изазваних патогенима отпорним на антибиотике.
Ова терапија се све више примењује као примарни или алтернативни третман за различита стања, укључујући упале, тровање угљен-моноксидом, хроничне ране, исхемијске болести и инфекције. Клиничка примена ХБОТ-а у лечењу инфекција је значајна, пружајући непроцењиве предности пацијентима.

Клиничка примена хипербаричне оксигенотерапије код инфекција
Тренутни докази снажно подржавају примену ХБО, како самосталног, тако и додатног третмана, што представља значајне користи за инфициране пацијенте. Током ХБО, притисак кисеоника у артеријској крви може порасти на 2000 mmHg, а резултујући високи градијент притиска кисеоника и ткива може подићи ниво кисеоника у ткиву на 500 mmHg. Такви ефекти су посебно вредни у подстицању зарастања инфламаторних реакција и поремећаја микроциркулације примећених у исхемијским срединама, као и у управљању компартмент синдромом.
ХБОТ такође може утицати на стања која зависе од имуног система. Истраживања показују да ХБОТ може сузбити аутоимуне синдроме и имуне одговоре изазване антигеном, помажући у одржавању толеранције графта смањењем циркулације лимфоцита и леукоцита док модулира имуне одговоре. Поред тога, ХБОТподржава зарастањекод хроничних кожних лезија стимулисањем ангиогенезе, кључног процеса за побољшани опоравак. Ова терапија такође подстиче стварање колагенског матрикса, неопходне фазе у зарастању рана.
Посебну пажњу треба посветити одређеним инфекцијама, посебно дубоким и тешко лечљивим инфекцијама као што су некротизирајући фасциитис, остеомијелитис, хроничне инфекције меких ткива и инфективни ендокардитис. Једна од најчешћих клиничких примена ХБО је код инфекција коже и меких ткива и остеомијелитиса повезаних са ниским нивоом кисеоника, које често изазивају анаеробне или резистентне бактерије.
1. Инфекције дијабетичког стопала
Дијабетичко стопалоЧиреви су честа компликација код дијабетичара, погађајући до 25% ове популације. Инфекције се често јављају у овим чиревима (чинећи 40%-80% случајева) и доводе до повећаног морбидитета и морталитета. Инфекције дијабетичког стопала (ИДС) обично се састоје од полимикробних инфекција са различитим анаеробним бактеријским патогенима. Различити фактори, укључујући дефекте функције фибробласта, проблеме са формирањем колагена, ћелијске имуне механизме и функцију фагоцита, могу ометати зарастање рана код дијабетичара. Неколико студија је идентификовало оштећену оксигенацију коже као снажан фактор ризика за ампутације повезане са ИДС.
Као једна од тренутних опција за лечење ДФИПријављено је да ХБОТ значајно побољшава стопу зарастања дијабетичких чирева на стопалу, што последично смањује потребу за ампутацијама и компликованим хируршким интервенцијама. Не само да минимизира потребу за процедурама које захтевају много ресурса, као што су операције режњева и пресађивање коже, већ такође представља ниже трошкове и минималне нежељене ефекте у поређењу са хируршким опцијама. Студија Чена и сарадника показала је да је више од 10 сеанси ХБОТ-а довело до побољшања стопе зарастања рана за 78,3% код дијабетичара.
2. Некротизујуће инфекције меких ткива
Некротизујуће инфекције меких ткива (НСТ) су често полимикробне, обично настају комбинацијом аеробних и анаеробних бактеријских патогена и често су повезане са продукцијом гасова. Иако су НСТ релативно ретке, показују високу стопу смртности због брзог напредовања. Благовремена и одговарајућа дијагноза и лечење су кључни за постизање повољних исхода, а ХБОТ се препоручује као додатна метода за лечење НСТ. Иако и даље постоје контроверзе око употребе ХБОТ код НСТ због недостатка проспективних контролисаних студија,докази указују на то да може бити повезано са побољшаним стопама преживљавања и очувањем органа код пацијената са НСТРетроспективна студија је указала на значајно смањење стопе смртности међу пацијентима са НСТ који примају ХБОТ.
1.3 Инфекције хируршког места
Инфекције места инфекција места инфекција могу се класификовати на основу анатомског места инфекције и могу настати из различитих патогена, укључујући и аеробне и анаеробне бактерије. Упркос напретку у мерама контроле инфекција, као што су технике стерилизације, употреба профилактичких антибиотика и побољшања у хируршкој пракси, инфекције места инфекција остају стална компликација.
Један значајан преглед истраживао је ефикасност ХБОТ у спречавању дубоких инфекција местоимуних рана (SSI) код операција неуромускуларне сколиозе. Преоперативна ХБОТ може значајно смањити учесталост SSI и олакшати зарастање рана. Ова неинвазивна терапија ствара окружење у којем су нивои кисеоника у ткивима ране повишени, што је повезано са оксидативним дејством убијања патогена. Поред тога, она се бави смањеним нивоима крви и кисеоника који доприносе развоју SSI. Поред других стратегија за контролу инфекција, ХБОТ се посебно препоручује за операције са чистом контаминацијом, као што су колоректалне процедуре.
1.4 Опекотине
Опекотине су повреде изазване екстремном топлотом, електричном струјом, хемикалијама или зрачењем и могу представљати високу стопу морбидитета и морталитета. ХБОТ је користан у лечењу опекотина повећавањем нивоа кисеоника у оштећеним ткивима. Иако студије на животињама и клиничке студије показују помешане резултате у вези саефикасност ХБОТ-а у лечењу опекотина, студија која је обухватила 125 пацијената са опекотинама показала је да ХБОТ није показао значајан утицај на стопу смртности или број извршених операција, али јесте смањио просечно време зарастања (19,7 дана у поређењу са 43,8 дана). Интеграција ХБОТ-а са свеобухватним лечењем опекотина могла би ефикасно да контролише сепсу код пацијената са опекотинама, што доводи до краћег времена зарастања и смањених потреба за течностима. Међутим, потребна су даља опсежна проспективна истраживања како би се потврдила улога ХБОТ-а у лечењу опсежних опекотина.
1.5 Остеомијелитис
Остеомијелитис је инфекција костију или коштане сржи коју често изазивају бактеријски патогени. Лечење остеомијелитиса може бити изазовно због релативно лошег снабдевања костију крвљу и ограниченог продора антибиотика у коштану срж. Хронични остеомијелитис карактеришу перзистентни патогени, блага упала и некротично формирање коштаног ткива. Рефракторни остеомијелитис се односи на хроничне инфекције костију које се настављају или понављају упркос одговарајућем лечењу.
Показано је да ХБОТ значајно побољшава ниво кисеоника у зараженим коштаним ткивима. Бројне серије случајева и кохортне студије указују да ХБОТ побољшава клиничке исходе код пацијената са остеомијелитисом. Чини се да делује кроз различите механизме, укључујући повећање метаболичке активности, сузбијање бактеријских патогена, појачавање дејства антибиотика, минимизирање упале и подстицање зарастања.процеси. Након ХБОТ-а, 60% до 85% пацијената са хроничним, рефракторним остеомијелитисом показује знаке супресије инфекције.
1.6 Гљивичне инфекције
Глобално, преко три милиона људи пати од хроничних или инвазивних гљивичних инфекција, што доводи до преко 600.000 смртних случајева годишње. Исходи лечења гљивичних инфекција су често угрожени због фактора као што су измењени имуни статус, основне болести и карактеристике вируленције патогена. ХБОТ постаје атрактивна терапијска опција код тешких гљивичних инфекција због своје безбедности и неинвазивне природе. Студије показују да ХБОТ може бити ефикасан против гљивичних патогена као што су Aspergillus и Mycobacterium tuberculosis.
ХБОТ промовише антифунгалне ефекте инхибирањем формирања биофилма код Aspergillus-а, са повећаном ефикасношћу примећеном код сојева којима недостају гени супероксид дисмутазе (СОД). Хипоксични услови током гљивичних инфекција представљају изазов за испоруку антифунгалних лекова, што повећане нивое кисеоника из ХБОТ-а чини потенцијално корисном интервенцијом, иако су потребна даља истраживања.
Антимикробна својства ХБОТ-а
Хипероксично окружење које ствара ХБОТ покреће физиолошке и биохемијске промене које стимулишу антибактеријска својства, што га чини ефикасном додатном терапијом за инфекције. ХБОТ показује изузетне ефекте против аеробних бактерија и претежно анаеробних бактерија кроз механизме као што су директно бактерицидно дејство, појачавање имуног одговора и синергијски ефекти са специфичним антимикробним средствима.
2.1 Директни антибактеријски ефекти ХБОТ-а
Директни антибактеријски ефекат ХБОТ-а се углавном приписује стварању реактивних врста кисеоника (РОС), које укључују супероксидне ањоне, водоник-пероксид, хидроксилне радикале и хидроксилне јоне - а сви они настају током ћелијског метаболизма.
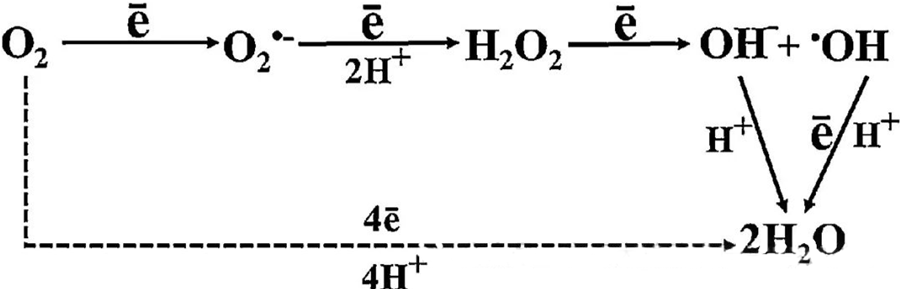
Интеракција између O₂ и ћелијских компоненти је неопходна за разумевање како се ROS формирају унутар ћелија. Под одређеним условима који се називају оксидативни стрес, равнотежа између формирања ROS и њихове разградње је поремећена, што доводи до повишених нивоа ROS у ћелијама. Производња супероксида (O₂⁻) је катализована супероксид дисмутазом, која потом претвара O₂⁻ у водоник-пероксид (H₂O₂). Ова конверзија је додатно појачана Фентоновом реакцијом, која оксидује Fe²⁺ да би генерисала хидроксилне радикале (·OH) и Fe³⁺, чиме се покреће штетна редокс секвенца формирања ROS и оштећења ћелија.
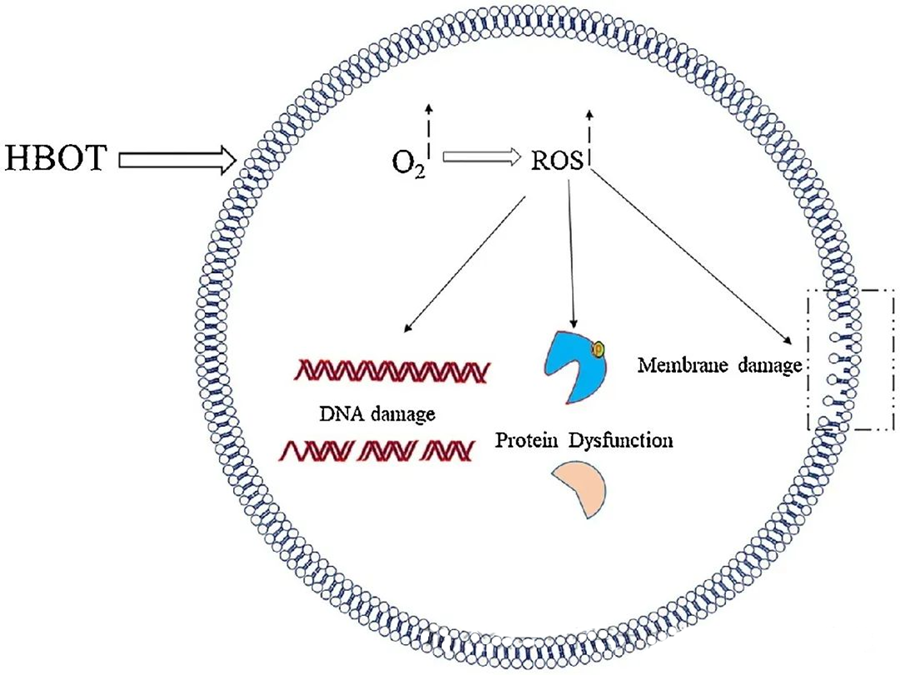
Токсични ефекти реактивних врста кисеоника (ROS) циљају критичне ћелијске компоненте као што су ДНК, РНК, протеини и липиди. Приметно је да је ДНК примарна мета цитотоксичности посредоване H₂O₂, јер нарушава структуре дезоксирибозе и оштећује базне саставе. Физичко оштећење изазвано ROS протеже се на хеликсну структуру ДНК, што је потенцијално резултат липидне пероксидације коју покрећу ROS. Ово наглашава негативне последице повишених нивоа ROS унутар биолошких система.
Антимикробно дејство РОС-а
Реактивне врсте кисеоника (ROS) играју виталну улогу у инхибирању раста микроба, што је показано кроз стварање ROS индукованих HBOT-ом. Токсични ефекти ROS директно циљају ћелијске састојке попут ДНК, протеина и липида. Високе концентрације активних врста кисеоника могу директно оштетити липиде, што доводи до липидне пероксидације. Овај процес угрожава интегритет ћелијских мембрана и, последично, функционалност рецептора и протеина повезаних са мембраном.
Штавише, протеини, који су такође значајне молекуларне мете РОС-а, подлежу специфичним оксидативним модификацијама на различитим аминокиселинским остацима као што су цистеин, метионин, тирозин, фенилаланин и триптофан. На пример, показано је да ХБОТ изазива оксидативне промене у неколико протеина у Е. coli, укључујући фактор елонгације G и DnaK, чиме утиче на њихове ћелијске функције.
Јачање имунитета путем ХБОТ-а
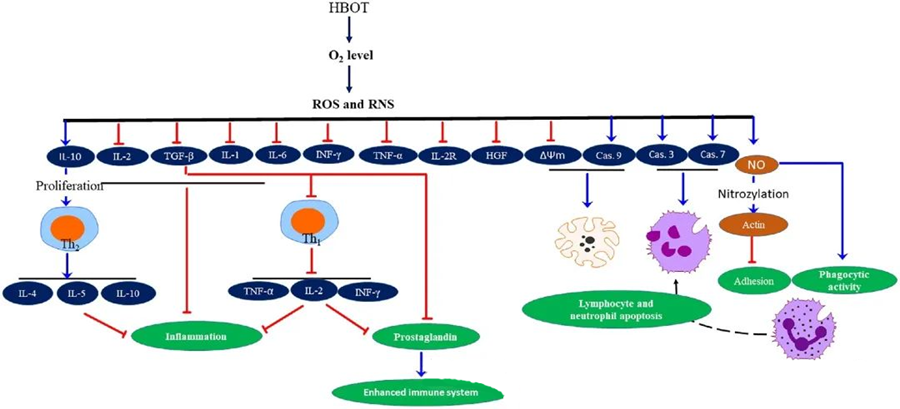
Антиинфламаторна својства ХБОТ-адокументовани су, што се показало кључним за ублажавање оштећења ткива и сузбијање прогресије инфекције. ХБОТ значајно утиче на експресију цитокина и других инфламаторних регулатора, утичући на имуни одговор. Различити експериментални системи су приметили различите промене у експресији гена и стварању протеина након ХБОТ-а, које или појачавају или понижавају факторе раста и цитокине.
Током процеса ХБОТ-а, повећани нивои О₂ покрећу низ ћелијских одговора, као што је сузбијање ослобађања проинфламаторних медијатора и подстицање апоптозе лимфоцита и неутрофила. Заједно, ове акције побољшавају антимикробне механизме имуног система, чиме се олакшава зарастање инфекција.
Штавише, студије указују да повећани нивои О₂ током ХБОТ-а могу смањити експресију проинфламаторних цитокина, укључујући интерферон-гама (IFN-γ), интерлеукин-1 (IL-1) и интерлеукин-6 (IL-6). Ове промене такође укључују смањење односа CD4:CD8 Т ћелија и модулацију других растворљивих рецептора, што на крају повећава нивое интерлеукина-10 (IL-10), који је кључан за сузбијање упале и подстицање зарастања.
Антимикробна активност ХБОТ-а је испреплетена са сложеним биолошким механизмима. Пријављено је да и супероксид и повишен притисак недоследно подстичу антибактеријску активност и апоптозу неутрофила изазвану ХБОТ-ом. Након ХБОТ-а, значајно повећање нивоа кисеоника побољшава бактерицидне способности неутрофила, што је есенцијална компонента имуног одговора. Штавише, ХБОТ сузбија адхезију неутрофила, која је посредована интеракцијом β-интегрина на неутрофилима са молекулима интерцелуларне адхезије (ICAM) на ендотелним ћелијама. ХБОТ инхибира активност неутрофилног β-2 интегрина (Mac-1, CD11b/CD18) путем процеса посредованог азотним оксидом (NO), доприносећи миграцији неутрофила ка месту инфекције.
Прецизно преуређење цитоскелета је неопходно да би неутрофили ефикасно фагоцитовали патогене. Показано је да S-нитрозилација актина стимулише полимеризацију актина, потенцијално олакшавајући фагоцитну активност неутрофила након претходног третмана ХБОТ-ом. Штавише, ХБОТ промовише апоптозу у људским Т ћелијским линијама путем митохондријалних путева, при чему је пријављена убрзана смрт лимфоцита након ХБОТ-а. Блокирање каспазе-9 - без утицаја на каспазу-8 - показало је имуномодулаторне ефекте ХБОТ-а.
Синергистички ефекти ХБОТ-а са антимикробним средствима
У клиничкој примени, ХБОТ се често користи заједно са антибиотицима за ефикасну борбу против инфекција. Хипероксично стање постигнуто током ХБОТ-а може утицати на ефикасност одређених антибиотских средстава. Истраживања сугеришу да специфични бактерицидни лекови, као што су β-лактами, флуорокинолони и аминогликозиди, не делују само путем инхерентних механизама, већ се делимично ослањају и на аеробни метаболизам бактерија. Стога су присуство кисеоника и метаболичке карактеристике патогена кључни приликом процене терапијских ефеката антибиотика.
Значајни докази показују да низак ниво кисеоника може повећати отпорност Pseudomonas aeruginosa на пиперацилин/тазобактам и да окружење са ниским садржајем кисеоника такође доприноси повећаној отпорности Enterobacter cloacae на азитромицин. Насупрот томе, одређени хипоксични услови могу повећати осетљивост бактерија на тетрациклинске антибиотике. ХБОТ служи као одржива додатна терапијска метода индуковањем аеробног метаболизма и реоксигенацијом хипоксично инфицираних ткива, што последично повећава осетљивост патогена на антибиотике.
У преклиничким студијама, комбинација ХБОТ-а — примењеног два пута дневно током 8 сати на 280 kPa — заједно са тобрамицином (20 mg/kg/дан) значајно је смањила бактеријско оптерећење код инфективног ендокардитиса изазване Staphylococcus aureus. Ово показује потенцијал ХБОТ-а као помоћног третмана. Даља истраживања су показала да је на температури од 37°C и притиску од 3 ATA током 5 сати, ХБОТ значајно појачао ефекте имипенема против Pseudomonas aeruginosa инфициране макрофагима. Поред тога, утврђено је да је комбиновани начин ХБОТ-а са цефазолином ефикаснији у лечењу остеомијелитиса изазване Staphylococcus aureus код животињских модела у поређењу са самим цефазолином.
ХБОТ такође значајно повећава бактерицидно дејство ципрофлоксацина против биофилмова Pseudomonas aeruginosa, посебно након 90 минута излагања. Ово побољшање се приписује формирању ендогених реактивних врста кисеоника (ROS) и показује повећану осетљивост код мутаната са дефектом пероксидазе.
У моделима плеуритиса изазваног метицилин-резистентним Staphylococcus aureus (MRSA), заједнички ефекат ванкомицина, теикопланина и линезолида са ХБОТ показао је значајно повећану ефикасност против MRSA. Метронидазол, антибиотик који се широко користи у лечењу тешких анаеробних и полимикробних инфекција као што су инфекције дијабетичког стопала (DFI) и инфекције хируршког места (SSI), показао је већу антимикробну ефикасност у анаеробним условима. Потребна су будућа истраживања како би се истражили синергијски антибактеријски ефекти ХБОТ-а у комбинацији са метронидазолом, како у in vivo, тако и у in vitro условима.
Антимикробна ефикасност ХБОТ-а на резистентне бактерије
Са еволуцијом и ширењем резистентних сојева, традиционални антибиотици често губе своју ефикасност током времена. Штавише, ХБОТ може бити неопходна у лечењу и спречавању инфекција изазваних патогенима отпорним на више лекова, служећи као кључна стратегија када третмани антибиотицима не успеју. Бројне студије су известиле о значајним бактерицидним ефектима ХБОТ-а на клинички релевантне резистентне бактерије. На пример, 90-минутна ХБОТ сесија на 2 АТМ значајно је смањила раст МРСА. Поред тога, у моделима односа, ХБОТ је побољшао антибактеријске ефекте разних антибиотика против МРСА инфекција. Извештаји су потврдили да је ХБОТ ефикасан у лечењу остеомијелитиса изазваног Клебсијелом пнеумоније која производи OXA-48, без потребе за било каквим додатним антибиотицима.
Укратко, хипербарична кисеонична терапија представља вишеструки приступ контроли инфекција, побољшавајући имуни одговор, а истовремено појачавајући ефикасност постојећих антимикробних средстава. Уз свеобухватна истраживања и развој, она има потенцијал да ублажи ефекте резистенције на антибиотике, пружајући наду у текућој борби против бактеријских инфекција.
Време објаве: 28. фебруар 2025.

